Александр Лукашенко:
— Мы внимательно подойдем к вопросу о том, что вы можете сделать гораздо больше. Потому что вы детей лечите. Вы лечите будущее нашей нации. Конечно, для них надо создать хорошие условия.
31 декабря 2020 года, во время посещения РНПЦ детской онкологии, гематологии и иммунологии.
— Мы внимательно подойдем к вопросу о том, что вы можете сделать гораздо больше. Потому что вы детей лечите. Вы лечите будущее нашей нации. Конечно, для них надо создать хорошие условия.
31 декабря 2020 года, во время посещения РНПЦ детской онкологии, гематологии и иммунологии.
Радоваться жизни с тобой
В сентябре этого года у 24-летнего жителя Гродно Никиты Скворцова состоялась долгожданная свадьба — молодой человек женился на своей любимой девушке Полине, которая оставалась рядом с ним на протяжении второго по счету этапа затяжной борьбы с тяжелой болезнью. Сейчас молодожены строят совместные планы на будущее. Долгое время они были лишены такого простого счастья, ведь никто не знал, что готовит Никите завтрашний день.— Все началось с того, что в 11-летнем возрасте у сына заболела нога, — рассказывает мама Никиты Ольга. — Были подозрения на ревматоидный артрит, но из-за того, что долго не получалось снизить высокую температуру, врачи в Гродно решили сделать пункцию костного мозга. Результаты оказались плохими. Нас направили в Минск, в нынешний РНПЦ детской онкологии, гематологии и иммунологии, где подтвердился диагноз — острый лимфобластный лейкоз. Это самое распространенное онкологическое заболевание у детей. Сначала все шло хорошо: Никита попал в счастливые 80 % пациентов, которым химиотерапия помогает выйти в ремиссию. Но спустя 10 лет наступил рецидив. Спровоцировать его могло что угодно — стресс, набор веса…
В 21 год юноша фактически превратился в инвалида — сильно болела спина, невозможно было сидеть, лежать. Когда узнал о вернувшейся болезни, почти ничего не почувствовал — морально был к этому готов давно, врачи честно предупреждали, что вероятность такого развития сценария, увы, имеется.
— За себя страха не было. Думал: один раз я через это проходил, пройду и второй, — признается Никита. — Но очень переживал за близких, что им снова предстоят месяцы неизвестности, отчаяния и надежды. Это сильно выматывает. Кому-то нужно было постоянно находиться рядом со мной, здесь, в РНПЦ. Дежурили попеременно мама, бабушка, Полина. Они жили в специальных арендных домиках на территории центра. В этот раз у меня было три курса химиотерапии, но в ремиссию я так и не вышел. Иммунитет отказывался отвечать на лечение.
 Ведущий научный сотрудник РНПЦ ДОГИ Ольга Карась и Никита Скворцов с женой Полиной.
Ведущий научный сотрудник РНПЦ ДОГИ Ольга Карась и Никита Скворцов с женой Полиной.— Врачи нам твердили: надежда есть всегда. И предложили CAR-T-терапию — инновационный метод, который дает шанс на жизнь пациентам с острыми лейкозами и лимфомами, у которых исчерпаны стандартные терапевтические протоколы. Как раз наш случай, — продолжает Ольга.
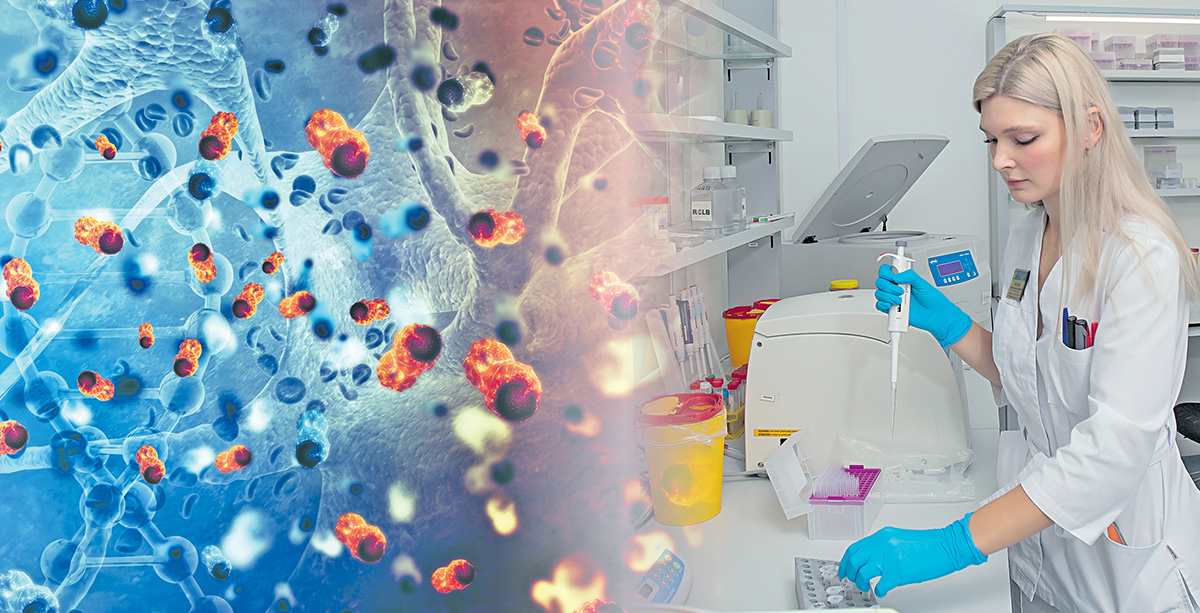
Немного о том, что представляет собой CAR-T-терапия. В основе этого нового вида лечения лежит использование собственных лимфоцитов человека, «перепрограммированных» против опухолевых клеток, находящихся в организме. Материалом здесь являются белые клетки крови самого пациента, которые забираются в ходе аппаратного афереза. Из полученной фракции клеток в лаборатории выделяют Т-лимфоциты, активируют их деление, после чего модифицируют путем введения в них искусственного химерного антигенного рецептора, способного распознавать опухоль и атаковать ее. Далее CAR-T-клетки выращивают в питательной среде до накопления их в необходимой дозе, а затем возвращают пациенту путем внутривенной инфузии.
Сегодня лечение этим методом, который в РНПЦ ДОГИ успешно используют с 2021 года, доступно не только детям до 18 лет, но и молодежи до 30 лет. Клеточная CAR-T-терапия демонстрирует обнадеживающие результаты у пациентов с опухолями, резистентными к химиотерапии. Более 80 % людей с диагнозом рефрактерного или рецидивирующего В-клеточного лимфобластного лейкоза достигают ремиссии. Среди них оказался и Никита Скворцов.
— Наконец-то живу нормальной жизнью — без больничных стен, процедур. Рад, что и мама теперь отдохнет, и младший братишка будет чаще ее видеть. Я очень благодарен врачам центра, их чуткому отношению, но, конечно, не хотелось бы возвращаться в РНПЦ на лечение. Согласен только на периодические обследования с хорошими новостями, — улыбается молодой человек.
Наука в практике
Более 90 % пациентов детского возраста с гематологическими, онкологическими заболеваниями, первичными иммунодефицитами получают специализированную медицинскую помощь в условиях РНПЦ ДОГИ. Ежегодно в структуре пролеченных пациентов около 70 % — со злокачественными новообразованиями, 18 % — с гематологическими диагнозами и иммунодефицитами. Такие данные приводит директор центра, доктор медицинских наук, профессор Анжелика Солнцева.— Анжелика Викторовна, какие научные направления деятельности РНПЦ сейчас получают активный импульс?

— В апреле прошлого года в Минске стартовал пилотный проект по скринингу новорожденных на первичный иммунодефицит (ПИД). Технология разработана специалистами вашего центра. Получит ли этот проект продолжение?
— Конечно. Скрининг уже проводится и на Брестчине, планируем в следующем году подключить остальные области, причем с использованием наших тест-систем. Объясню, почему это важно. Дело в том, что такой метод позволяет в 100 % случаев выявлять тяжелую форму врожденной недостаточности иммунитета и тем самым спасать жизни новорожденных. Врожденные нарушения иммунитета долгое время считались редкими заболеваниями, однако с развитием диагностики оказалось, что это не так. По статистике, на 2000 родов появляется на свет 1 ребенок, имеющий те или иные молекулярно-генетические дефекты, проявляющиеся нарушениями в работе иммунной системы. На конец 2022 года было известно уже 485 вариантов ПИД, и этот список ежегодно пополняется. Наиболее опасная форма — тяжелая комбинированная иммунная недостаточность (ТКИН), когда нарушается образование Т- и В-лимфоцитов. Такие малыши внешне выглядят здоровыми, общие и биохимические анализы крови у них в норме, и заподозрить заболевание без специальных исследований невозможно. Патология проявляется в первые месяцы жизни, когда ребенок сталкивается с инфекцией, госпитализируется в стационар, попадает в реанимацию. К сожалению, абсолютное большинство пациентов с ТКИН погибают, не дожив до года. Но если мы успеем словить промежуток от рождения до начала проявления заболевания, то малыша можно спасти. Стоимость одного скринингового исследования на ПИД для бюджета составляет около 30 рублей, дополнительного обследования с установлением генетической причины — от 150 до 3000 рублей. Подсчитано, что экономия на диагностику и лечение при раннем выявлении ПИД (в возрасте до 3 месяцев) — не менее 300 тысяч рублей.
— Наиболее частая и агрессивная опухоль у малышей до 3 лет — нейробластома. Есть ли какие-то подвижки в ее лечении?
— ДНК-вакцины против нейробластомы относятся к числу наших перспективных разработок. Вакцинотерапия при этом диагнозе успешно сочетается с другими видами противоопухолевого лечения, при этом достигается максимально высокий противорецидивный эффект. Клинические испытания уже прошли 6 пациентов, 4 находятся в ремиссии.
Отмечу также, что мы занимаем лидирующую позицию в диагностике врожденных дефектов иммунной системы у детей — орфанных, сложно диагностируемых заболеваний. Нашему РНПЦ присвоен статус Международного центра по диагностике и лечению первичных иммунодефицитов имени Джеффри Моделла, который объединяет более 50 организаций в Европе и США. Благодаря высокотехнологичному подходу в 2022 году этот диагноз был установлен более чем 620 пациентам, что в 4 раза больше показателя десятилетней давности.
Только индивидуальный подход
Несмотря на очевидные научные достижения в лечении злокачественных новообразований, которые сегодня отмечаются как в Беларуси, так и во многих других странах, человечество ждет ответа на вопрос: когда наконец появится вакцина от рака? Почему есть возможность прививаться от полиомиелита, гриппа, ковида, коклюша и т.д., но нет даже призрачной возможности благодаря чудодейственной инъекции убить в зародыше неконтролируемое деление клеток в организме?Громкий заголовок российских СМИ: «В ближайшее время в РФ начнутся клинические испытания вакцины против рака». Ученые надеются, что этот препарат значительно увеличит продолжительность жизни пациентов с онкологическими заболеваниями и поможет избежать рецидивов. Правда, в интервью Лента.ру директор Научно-исследовательского института экспериментальной диагностики и терапии опухолей Национального медицинского исследовательского центра онкологии имени Н. Н. Блохина кандидат биологических наук Вячеслав Косоруков поясняет:
— Важно понимать, что это вовсе не панацея. Некоторые думают, что речь идет о чудодейственном средстве, которое может вылечить все. Однако это не так. Вакцина будет эффективна только при определенных видах рака, для которых показано применение иммунотерапии. Пока это ограниченный список заболеваний, например меланома. В будущем туда могут войти рак легкого, некоторые виды рака ЖКТ и, возможно, рак почки. Для каждого из этих видов рака необходимо провести отдельные испытания, чтобы подтвердить эффективность вакцины. Это большая работа, которую мы планируем выполнить в кратчайшие сроки. Препарат будет создаваться индивидуально для каждого пациента на основе его генома и генома его опухоли. После операции такая вакцина будет выполнять роль лекарственного средства, то есть станет терапевтической вакциной.
— В том-то все и дело, что на современном этапе развития науки мы можем вести речь только о создании лекарственного средства, но не вакцины в понимании профилактики болезни, — говорит директор Института биофизики и клеточной инженерии Национальной академии наук Беларуси кандидат медицинских наук Андрей Гончаров. — Скорее всего, такие препараты условно называют вакцинами потому, что они нацелены на стимуляцию иммунитета и его активацию на борьбу с новообразованием.
Возбудители большинства инфекционных заболеваний со временем почти не меняются. Когда создается вакцина против, к примеру, дифтерии, ее компоненты нацелены на конкретные белки, конкретные антигены, которые хорошо известны медикам. Поэтому мы можем привить огромное количество людей одним и тем же препаратом. А вот с онкологическими заболеваниями все намного сложнее: у каждого пациента свой набор антигенов (их принято называть неоантигены), свои мутации, иногда многочисленные. Да, есть случаи, когда присутствуют какие-то общие мутации, формирующиеся у многих пациентов, но это скорее исключение из правил. Поэтому сегодня перед наукой стоит задача идентифицировать неоантигены каждого конкретного пациента, на основе полученных данных создать индивидуальное лекарственное средство и ввести его в организм. Это будет способствовать более успешному лечению. Что же касается общей профилактической вакцины от рака — пока этот вопрос остается открытым.
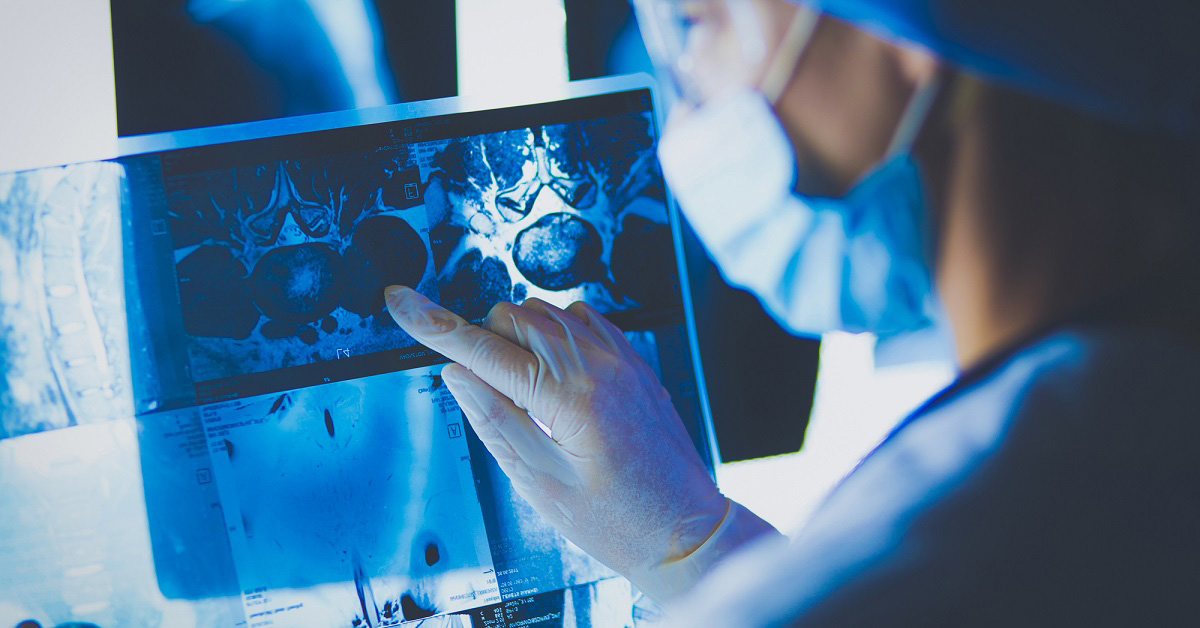
Задача на улучшение
Научный сотрудник РНПЦ ДОГИ Евгений Ласюков изучает вопросы прикладной иммунологии и входит в состав команды специалистов, которая занимается исследованиями в области CAR-T-терапии:
— В данный момент перед нашей командой стоит задача улучшить химерный антигенный рецептор для CAR-Т-терапии. Если объяснять простыми словами, на поверхности клетки есть, скажем так, опухолевый белок — CD-19. Он имеет неприятное свойство периодически пропадать из поля зрения нашего модифицированного инструмента, который должен его распознать и атаковать. В этом случае вся терапия неэффективна, возможен рецидив заболевания. Наша цель — создать рецептор, способный распознать и другие белки, свойственные опухоли. Таким образом значительно уменьшаются риски рецидивов, а выживаемость пациентов повышается.
Больше не приговор
— Сегодня общая пятилетняя выживаемость детей со злокачественными новообразованиями составляет 82 %, а по некоторым нозологическим формам (например, при лимфогранулематозе, ретинобластоме, нефробластоме, хроническом миелоидном лейкозе) доходит до 95 %. Для сравнения: еще в 1997 году этот показатель не превышал 56 %, в 2007-м был на уровне 74 %.
КСТАТИ
В этом году в РНПЦ ДОГИ появился новый генетический анализатор, который способен за один раз расшифровать весь геном человека. Это первый в Беларуси прибор такой высокой производительности, сертифицированный для выполнения диагностики in vitro.
Полноэкзомное секвенирование — это метод, позволяющий исследовать весь экзом человека, то есть совокупность всех кодирующих участков генома. Анализ дает возможность врачам быстро определить истинную причину заболевания и назначить эффективное лечение. Полноэкзомное секвенирование может быть особенно полезно в случаях, когда существует подозрение на несколько генетических заболеваний или предыдущие тесты не дали четкого результата.
В ТЕМУ
В структуре заболеваемости злокачественными новообразованиями у маленьких белорусов лидирующую позицию занимают лейкозы, составляя 25 % всех случаев. На втором месте — опухоли центральной нервной системы, на долю которых приходится 20 %, на третьем — лимфомы (15 %).
lvk@sb.by